“当我们清晰地看到鞭毛马达的结构后,不得不惊叹于大自然和生命的奇妙。这是一个 6.3 兆达尔顿(MDa)的超大复合物,高约 460 埃,直径约 260 埃,包含了 12 种不同的蛋白质,总共有 175 个亚基。”谈及不久前被 Cell 报道的成果,浙江大学生命科学研究院朱永群教授表示。
细菌的运动能力,远超陆地上跑得最快的猎豹。很多细菌 1 秒钟就能跑出自己身长的 60-100 倍的距离,这个运动能力连高铁也难以企及。
为什么细菌具有如此非凡的运动能力?答案只有两个字 —— 鞭毛,这是细菌的运动器官,也是一种独特的蛋白质纳米机器。
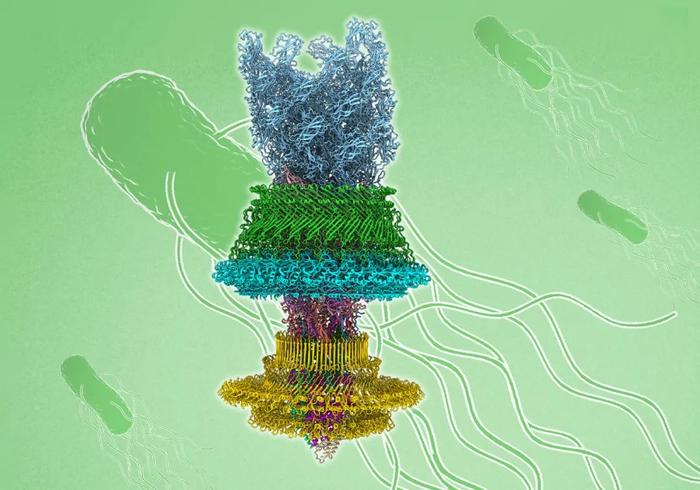 图 | 鞭毛马达结构(来源:朱永群)
图 | 鞭毛马达结构(来源:朱永群)鞭毛的主要结构包括:细胞外的接头装置、细菌膜上的马达以及鞭毛丝,横跨细菌内外膜并延伸到细菌细胞外。
细菌跑这么快,主要目的包括获取营养物质、躲避人类免疫系统的 “追杀”、或者寻找生存环境和感染位置。
 图 | 白细胞追杀细菌(来源:SOOGIF)
图 | 白细胞追杀细菌(来源:SOOGIF)此前几十年间,人类对鞭毛马达做了大量研究,如负染观察结构、预测组成成份、荧光检测旋转规律等。
但依然存在长期悬而未决的难题:比如我们仍旧不清楚它的详细结构、组装机制、以及实现高效扭矩传输进而驱动鞭毛丝高速运转的原理。
近日,朱永群团队和该校医学院张兴教授团队,联合揭示了细菌 “快速运动之谜”,细菌鞭毛马达工作原理终于得以解开,这一成果将给抗生素设计带来新思路。
 图 | 沙门氏菌及其鞭毛示意图(来源:朱永群)
图 | 沙门氏菌及其鞭毛示意图(来源:朱永群)4 月 20 日,相关论文以《细菌鞭毛马达的组装和扭矩传递的结构基础》“Structural Basis of Assembly and Torque Transmission of the Bacterial Flagellar Motor” 发表在 Cell 上。
 图 | 本次研究团队成员:左三为朱永群,右三为张兴(来源:浙江大学)
图 | 本次研究团队成员:左三为朱永群,右三为张兴(来源:浙江大学)其中,朱永群和张兴担任通讯作者,论文一作为朱永群实验室的研究生谭加兴、博士后王小飞、以及张兴实验室的研究生徐彩煌和张兴教授本人。
 图 | 相关论文(来源:Cell)
图 | 相关论文(来源:Cell)朱永群告诉 DeepTech,该论文解析了来自病原菌沙门氏菌在天然状态下的鞭毛马达 - 接头装置复合物的原子分辨率冷冻电镜结构,它的总分子量超过 6.3 MDa,共包含 175 个亚基。
该研究首次以高清形式,展示了鞭毛马达的不同组件如联动杆、外膜环、周质环、内膜环、分泌装置、接头装置等,也首次系统地揭示了沙门氏菌鞭毛马达的组装和扭矩传输机制。
 图 | 鞭毛马达结构与工作机制的示意图(来源:Cell)
图 | 鞭毛马达结构与工作机制的示意图(来源:Cell)由于细菌鞭毛马达每秒钟可旋转 300-2400 圈,再加上其结构的高度复杂性,其一直被认为是最复杂的蛋白质机器之一,也被认为是自然界中最精密、最高效的分子引擎之一,对于它的工作机制,人类一直搞不清楚。
朱永群坦言:“为了解决这一世界难题,我们希望解析它的高分辨结构。我们碰到的第一个难点就是如何完整地提取鞭毛马达,它太大了!”
 图 | 鞭毛马达(来源:朱永群)
图 | 鞭毛马达(来源:朱永群)采用同源重组基因敲除法,敲除相关基因
研究中,朱永群和团队采用同源重组基因敲除的方法,敲除了沙门氏菌基因组上编码鞭毛丝蛋白 FliC 的基因、以及其帽子蛋白 FliD 的基因,这样做的目的是可以排除鞭毛丝及其异质性、以及传统酸碱处理法对鞭毛马达纯化的影响。
通过大量实验,他们设计出了相对温和的鞭毛马达纯化步骤,并获得了完整且稳定的鞭毛马达及接头装置复合物样品。
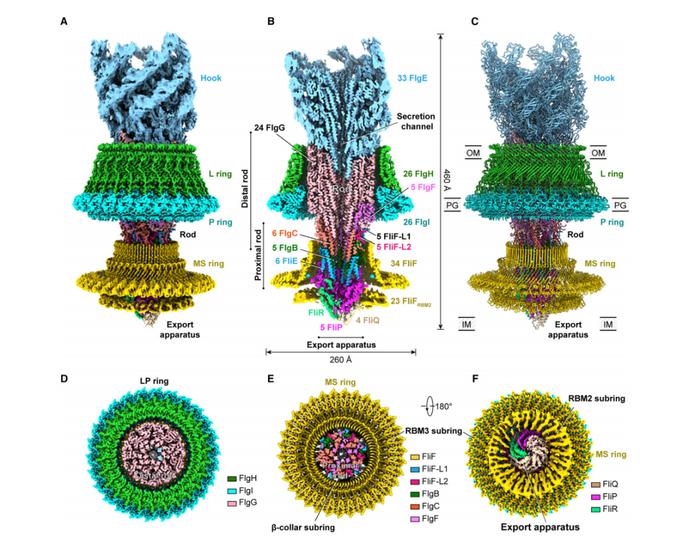 图 | 鞭毛马达总体结构(来源:Cell)
图 | 鞭毛马达总体结构(来源:Cell)内膜环是鞭毛马达的组装底座,它不仅会旋转,还能接受来自质子泵和胞质区环传来的扭矩,从而把扭矩传给联动杆。
但在真实状态下,内膜环是否具有对称性,一直以来颇有争议。而本次研究首次证明了内膜环在天然状态下,其内部存在着高度对称错位。
比如,内膜环上部的 RBM3 区和 β-collar 具备 C34 对称性,底部 RBM2 区则采取 C23 对称性,并且内膜环的顶部伸出了 10 个多肽链。

(来源:Cell)
此外,他们还发现,内膜环底部 RBM2 区紧紧卡住分泌装置,β-collar 和 RBM3 则包围着分泌装置、并联动着杆下端。
其中,分泌装置由 1 个 FliR 亚基、4 个 FliQ 亚基、和 5 个 FliP 亚基组成。作为联动杆的组装平台,分泌装置还决定着联动杆的组装方式。另外,分泌装置还会分泌各种鞭毛组装蛋白,并逐步形成联动杆,进而形成细菌胞外的鞭毛丝和接头装置。
 图 | 内膜环结构及与联动杆的相互作用(来源:Cell)
图 | 内膜环结构及与联动杆的相互作用(来源:Cell)给鞭毛马达的错误推论按下休止符
朱永群表示,联动杆是由 46 个亚基组成的螺旋杆状结构,其刚性非常高。此前科学家们使用质谱和同位素标记等方法,试图来分析联动杆的组成,但始终没有定论,一些推论也出现了相互矛盾。
而本次研究显示,联动杆结构呈现出十分致密的螺旋杆状,它由 46 个亚基和 5 个蛋白组成,其中远端联动杆由 5 个 FlgF 和 24 个 FlgG 组成,近端联动杆则由 5 个 FlgB、6 个 FlgC 和 6 个 FliE 组成。
虽然不同的联动杆蛋白,拥有相似的基础特征,但它们的结构特点完全不相同。此外,各个亚基都能和周围的亚基彼此锁定,整个联动杆的高度刚性也可得到保证。
其中,FlgG 蛋白的 GSS 区,可形成类似于 “楔子” 的形状,把其插入远端联动杆表面的空隙中,就可极大增强联动杆的刚性,从而保证联动杆的高效扭矩传输和高速旋转。

(来源:Cell)
他们还发现,通过利用 FliE、FlgB 亚基、以及 10 条多肽链,去向联动杆传输扭矩,这样就能克服联动杆螺旋结构、和内膜环圆盘结构两者之间的结构不对称性,进而让扭矩传输从水平方向、转换到垂直方向。
此外,通过不规则的结构区连接,内膜环与多肽链可以连接 6 个小螺旋结构、5 个环结构、以及联动杆近端的区域。

(来源:朱永群)
以上这些不规则的结构区,不仅能保证细胞柔性,还可充当履带作用,进而把扭矩从内膜环上传到联动杆上。如此一来,非常致密的刚性联动杆,就能进一步把扭矩从近端传输到远端。
值得注意的是,外膜环和周质环的彼此紧扣,能形成一种桶状结构。其中,26 个 FlgH 亚基组成了外膜环。
而外膜环还具备双层 β- 桶结构,顶端的 α 螺旋可通过水平排列、形成外膜结合区。通过 N 端半胱氨酸上的脂肪基团,前述 26 个 FlgH 亚基则可进一步锚定在外膜上。
 图 | “外膜 - 周质环” 结构及与联动杆的相互作用(来源:Cell)
图 | “外膜 - 周质环” 结构及与联动杆的相互作用(来源:Cell)联动杆在高速旋转时,不会产生摩擦以及能量损耗
研究还发现,在使用恒定氨基酸残基和静电斥力时,“外膜 - 周质环” 会形成一种氢键环,这可确保联动杆在高速旋转时,不会产生摩擦以及能量损耗。
另外,由于 “外膜 - 周质环” 套在联动杆的远端,而外膜环的内表面全部带有负电,正好能和全带负电的联动杆远端产生静电互斥,从而大大减小联动杆和外膜环之间的阻力,联动杆的高速旋转也可得到保证。
而通过围绕联动杆的远端,周质环能和后者形成一个氢键相互作用环。在联动杆远端的、参与以上氢键环并形成的氨基酸残基,均是固定的残基,比如天冬酰胺、谷氨酰胺、谷氨酸等。而在周质环上参与上述氢键环的残基,也都是不变的谷氨酰胺和赖氨酸等残基。

(来源:Cell)
因此,联动杆在旋转时,周质环与联动杆远端之间的氢键可进行重建,且无需消耗任何能量。打个比方,氢键环就好比轴承中的钢珠球,不仅能保证联动杆不跑偏,而且不会损耗扭矩传输中的能量。
 图 | 细胞鞭毛(来源:Pixabay)
图 | 细胞鞭毛(来源:Pixabay)对微生物学课本有所了解就能知道,细菌鞭毛其中的基本内容。本次研究揭开了鞭毛马达的神秘面纱,面纱背后的内容是:鞭毛马达通过各结构元件间的精妙配合,可将质子泵转化来的机械能,并可毫无损耗地传给鞭毛丝,此后便可促进鞭毛丝高速转动,从而让细菌进行快速运动。
朱永群表示,本次揭示出的细菌鞭毛马达结构与机制,也是微生物领域重要突破。研究中,他和团队还发现,鞭毛马达的扭矩传输机制,完全迥别于另一种分子马达 ATP 合成酶,这说明自然界分子马达的工作原理具有多样性。
简单来说,这一发现也可帮助人们更好地认识微观世界的分子发动机,并可为合成生物学、纳米机器人等研究提供新的启发。











