胃癌是全球常见的癌症之一,也是导致癌症死亡的三大主要原因之一[1]。我国更是胃癌的高发国家,全世界每年有40%以上的新发和死亡病例发生在我国[2]。
在目前,化疗是胃癌的主要治疗方法之一,无论是围手术期还是术后使用都能显著增加患者的生存率[3]。常用的化疗药物有5-氟尿嘧啶(5-FU)及其改良版口服剂——S-1(替加氟+吉美嘧啶+奥替拉西)和UFT(替加氟+尿嘧啶)。除此之外,紫杉烷类药物(多西他赛和紫杉醇等)也已证明能够给胃癌患者带来生存收益[4]。
与单药相比,联合疗法一般能获得更好的临床疗效。然而,虽然一项来自日本的研究证明联用S-1与紫杉醇(Pac)能够带来生存获益[5],但同时也有其他研究报道了相反的结果[6]。
这样矛盾的结果表明仅有部分人群适用于Pac联合疗法,因此,如果能找到这部分人群的生物标志物,便能给临床中制定用药方案提供非常重要的参考。
近日,来自杜克-新加坡国立大学医学院的Patrick Tan教授报道了该领域的最新研究成果。他们利用机器学习技术,发现了对紫杉醇治疗敏感胃癌患者的19个标签基因(见文章末尾)。相关结果发表在国际著名期刊Gut上[7]。
 论文首页截图
论文首页截图本研究基于胃癌辅助治疗多机构组试验(SAMIT),是世界上最大的胃癌临床试验之一。参与受试的1495名胃癌患者术后随机分为四组:单纯UFT治疗组(UFT arm),单纯S-1治疗组(S-1 arm),UFT联合紫杉醇治疗组(Pac-UFT arm)以及S-1联合紫杉醇治疗组(Pac-S-1 arm)。每组患者的年龄性别等一般情况和和临床病理特征均无明显差异。
为了寻找其基因层面的生物标志物,研究者从患者肿瘤组织石蜡包块中提取RNA,并通过定制的NanoString转录组技术进行测序。有552名患者的肿瘤组织样本可用于RNA提取,其中499个RNA样本通过了NanoString的质控检测。
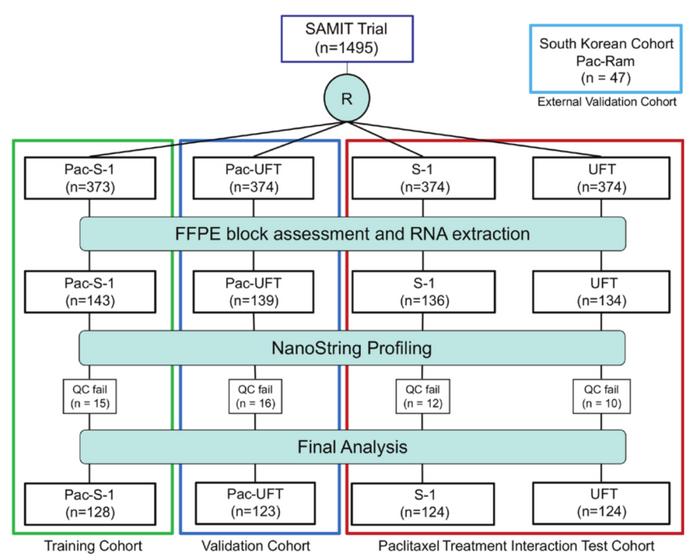
研究流程图
研究者以无病生存时间(DFS)作为标准,将接受Pac治疗的患者分为Pac敏感组(DFS≥2年)和Pac不敏感组(DFS<2年)。然而,经过NanoString测序后,研究人员并没有发现两组患者在基因表达水平上的区别。同时,使用COX单变量回归分析后也没有发现任何单基因表达水平与DFS相关。
但既然二者对Pac的敏感性存在差异,同时其一般情况和临床病理特征又无明显差异,我们似乎只能从基因水平来解释这个现象。因此,研究者选择构建随机森林机器学习模型,用以寻找能够将Pac敏感组和不敏感组区分开的标签基因。
由于目前临床上多以S-1治疗作为标准化治疗,研究者选择Pac-S-1组作为训练数据,将Pac-UFT组作为内部验证数据。
经过模型训练,研究者最终筛选出19个标签基因。根据这些标签基因,研究者在Pac-UFT组中进行了分类验证。令人兴奋的是,根据这些基因分类为Pac敏感的患者获得了更好的生存收益(DFS≥3年患者比例为66%,Pac不敏感的患者中DFS≥3年比例为40%)。这些标记基因的风险比(HR)为0.44,logrank p=0.0029。
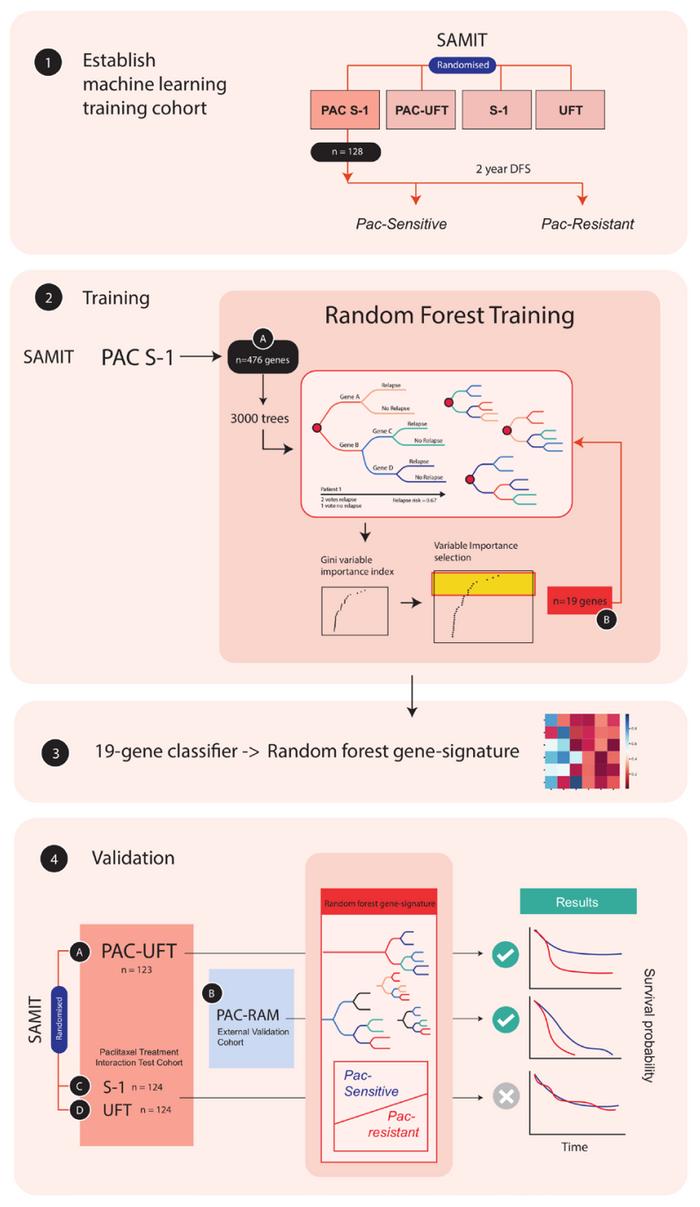
模型训练及验证策略
为了进一步验证这些标签基因的可信度,研究者在另外一个独立的队列(Pac-Ram)中进行验证。Pac-Ram队列是一个包含47个患者的单臂非随机2期临床试验,主要为观察Pac联合雷莫昔单抗治疗转移性胃癌的疗效。
通过19个标签基因将患者进行分类后,分类为Pac敏感的患者同样表现出很好的生存收益(由于Pac-Ram队列是转移性胃癌队列,研究者在这里选择无进展生存时间(PFS)来描述生存收益)。分类为Pac敏感患者的中位PFS为147天,而Pac不敏感患者的中位PFS为112天。标记基因的HR为0.48,logrank p=0.022。

Pac-UFT队列(基于DFS)和Pac-Ram队列(基于PFS)的Kaplan-Meier生存曲线
总体来说,本文的研究者通过世界上最大的紫杉醇辅助治疗胃癌队列数据,确定了能够从紫杉醇中获益的患者的标签基因。鉴于临床中紫杉烷类的使用越来越多,这种生物标记物的确认能够对临床医生的治疗方案的选择提供非常好的指导。不过,这些标签基因的实际功效还有待前瞻性研究进行验证。
附:本文中提到的19个标签基因:
CD209, TOP3B, BCL2, MCM2, RAD9A, IL10, HLA-DMB, MCM10, PTPRC, FANCM, ADORA2A, MS4A1, FANCG, CD3G, DSCR6, TBX21, ZWILCH, IL17A 及 FCGR3A。

参考文献:
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018 Nov;68(6):394-424. doi: 10.3322/caac.21492. Epub 2018 Sep 12. Erratum in: CA Cancer J Clin. 2020 Jul;70(4):313. PMID: 30207593.
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016 Mar-Apr;66(2):115-32. doi: 10.3322/caac.21338. Epub 2016 Jan 25. PMID: 26808342.
3. Kang YK, Cho H. Perioperative FLOT: new standard for gastric cancer? Lancet. 2019 May 11;393(10184):1914-1916. doi: 10.1016/S0140-6736(18)33189-1. Epub 2019 Apr 11. PMID: 30982685.
4. Kanagavel D, Fedyanin M, Tryakin A, Tjulandin S. Second-line treatment of metastatic gastric cancer: Current options and future directions. World J Gastroenterol. 2015 Nov 7;21(41):11621-35. doi: 10.3748/wjg.v21.i41.11621. PMID: 26556991; PMCID: PMC4631965.
5. Kodera, Yasuhiro, et al. "A randomized phase III study comparing S-1 plus docetaxel with S-1 alone as a postoperative adjuvant chemotherapy for curatively resected stage III gastric cancer (JACCRO GC-07 trial)." (2018): 4007-4007.
6. Bajetta E, Floriani I, Di Bartolomeo M, Labianca R, Falcone A, Di Costanzo F, Comella G, Amadori D, Pinto C, Carlomagno C, Nitti D, Daniele B, Mini E, Poli D, Santoro A, Mosconi S, Casaretti R, Boni C, Pinotti G, Bidoli P, Landi L, Rosati G, Ravaioli A, Cantore M, Di Fabio F, Aitini E, Marchet A; ITACA-S (Intergroup Trial of Adjuvant Chemotherapy in Adenocarcinoma of the Stomach Trial) Study Group. Randomized trial on adjuvant treatment with FOLFIRI followed by docetaxel and cisplatin versus 5-fluorouracil and folinic acid for radically resected gastric cancer. Ann Oncol. 2014 Jul;25(7):1373-1378. doi: 10.1093/annonc/mdu146. Epub 2014 Apr 12. PMID: 24728035.
7. Sundar R, Barr Kumarakulasinghe N, Huak Chan Y, Yoshida K, Yoshikawa T, Miyagi Y, Rino Y, Masuda M, Guan J, Sakamoto J, Tanaka S, Tan AL, Hoppe MM, Jeyasekharan AD, Ng CCY, De Simone M, Grabsch HI, Lee J, Oshima T, Tsuburaya A, Tan P. Machine-learning model derived gene signature predictive of paclitaxel survival benefit in gastric cancer: results from the randomised phase III SAMIT trial. Gut. 2021 May 12:gutjnl-2021-324060. doi: 10.1136/gutjnl-2021-324060. Epub ahead of print. PMID: 33980610.
责任编辑丨BioTalker











