血管内皮细胞能够合成并释放特异性生长因子,调控微环境中细胞间的一系列生物活动[1]。随着血管分泌因子(angiocrine factors)在成骨与骨重建过程中的作用被广泛认可,H型内皮细胞(CD31hiEMCNhi)作为其重要来源引发了越来越多的研究。其中既有对H型内皮细胞在成血管-成骨偶联过程中作用的探讨,也有其他细胞对H型内皮细胞调控的研究。因此,本文通过综述近年来的相关研究,阐述H型内皮细胞的特性及其在成血管-成骨偶联中的作用,为更好地挖掘该细胞潜在的临床价值奠定基础。
一、H型内皮细胞的特性
(一)空间分布与转归
为探究体内血管内皮细胞的异质性,Kusumbe等[2]对骨骼及其他器官中内皮细胞的表面标记物行免疫荧光检测,首次发现血小板内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1, PECAM-1/CD31)及内皮粘蛋白(endomucin, EMCN)强阳性的内皮细胞特异性地分布于肝脏微血管、骨内膜及长骨干骺端,且这些区域中细胞增殖与代谢较周围区域更快。基于上述内皮细胞空间分布及表面标记物的特点,Kusumbe等[2]提出了H型内皮细胞(CD31hiEMCNhi)与L型内皮细胞(CD31loEMCNlo)的概念。在长骨内,H型内皮细胞形成的H型微血管主要在分布于骨内膜与干骺端,并在干骺端形成特殊的柱状及拱形结构;而L型微血管分布于髓腔中形成血管窦[3]。利用共聚焦显微镜观察H型微血管与L型微血管,可发现两者在干骺端与骨干的交界面处相连,证明H型微血管与L型微血管组成了连续的血管床[2]。向小鼠体内H型内皮细胞转染绿色荧光蛋白(green fluorescent protein, GFP)后,GFP的表达区域由干骺端及骨内膜逐渐向骨干扩张,加之H型内皮细胞本身具有较高的增殖水平,Kusumbe等[2]提出H型内皮细胞能够转化为L型内皮细胞。
(二)特殊的成血管分子表达谱
尽管骨滋养动脉的主要分支直接向H型微血管供血,使H型内皮细胞所在区域氧含量较高,但免疫组化及体外细胞实验证实H型内皮细胞缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)的表达水平高于L型内皮细胞[2]。在体内敲除或抑制内皮细胞HIF-1α基因后,骨骼内H型内皮细胞数量显著减少,而L型内皮细胞数量无明显变化,可见HIF-1α在内皮细胞中的高水平表达对其H型内皮细胞表型的产生和维持起重要作用[2,4,5]。此外,Langen等[6]发现H型内皮细胞的血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)表达水平明显高于L型内皮细胞,使其对VEGF信号更为敏感。Ji等[7]将VEGFR拮抗剂应用于小鼠后,小鼠骨骼内H型内皮细胞数量显著下降,证明内皮细胞中VEGFR的高表达与HIF-1α类似,也与H型内皮细胞表型的产生紧密相关。
二、H型内皮细胞对成骨的调控作用
(一)促进成骨细胞系增殖与迁移
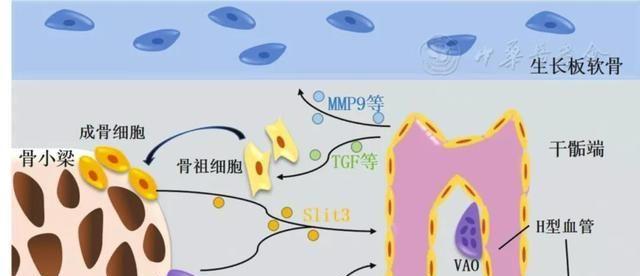
通过收集并分析临床数据,Wang等[8]发现骨骼内H型内皮细胞数量与年龄增长呈负相关,且H型内皮细胞数量减少将增加骨折及骨质疏松的风险。Kusumbe等[2]利用实时荧光定量PCR发现H型内皮细胞中与骨祖细胞存活、增殖相关的血小板衍生生长因子(platelet derived growth factor, PDGF)、转化生长因子(transforming growth factor, TGF)等细胞因子的表达水平明显高于L型内皮细胞;免疫荧光结果显示血小板衍生生长因子受体β(platelet-derived growth factor receptor-beta, PDGFRβ)阳性的间充质干细胞、Runt相关转录因子2(runt-related transcription factor 2, RUNX2)及成骨相关转录因子(osterix, OSX)阳性的骨祖细胞、Ⅰ型胶原α1阳性的成骨细胞在干骺端与骨内膜聚集,并与H型内皮细胞间存在明显的空间相关性。通过敲除内皮细胞HIF-1α减少骨骼内H型微血管数量后,骨内RUNX2+OSX+骨祖细胞数量也随之下降,导致骨小梁结构受损,骨皮质变薄,证实H型内皮细胞对成骨细胞系的维持作用[2]。
在骨缺损修复模型中,Wang等[9]发现修复区H型内皮细胞数量在3 d内即有明显上升,而此时OSX+骨祖细胞及成骨细胞主要分布于修复区周围的骨膜内,并逐渐向修复区中心迁移。Ji等[7]对骨内钛植入模型进行免疫荧光检测,同样发现在植入物周围的修复区内存在H型内皮细胞与成骨细胞的先后聚集。通过拮抗VEGFR减少骨骼内H型内皮细胞数量后,修复区OSX+细胞数量随之明显减少,导致修复区骨再生受损,验证了H型内皮细胞能够促进成骨细胞系的增殖及迁移,从而对骨再生过程发挥正向调控作用[7]。
(二)促进生长板软骨吸收
软骨吸收是骨骼发育及修复过程中的重要环节[10],在发育期抑制骨骼血管新生会导致生长板过度肥大,骨发育受限[11],但其具体机制尚不明确。近期,Romeo等[12]分别提取H型内皮细胞与破骨细胞,并检测两者骨骼基质消化相关蛋白酶的表达水平,结果显示H型内皮细胞中基质金属蛋白酶(matrix metallopeptidase, MMP)等部分基质消化酶的表达水平更高,其中MMP9的表达量可达破骨细胞的40倍。此外,在敲除内皮细胞MMP9的小鼠模型中,Romeo等[12]观察到生长板过度肥大,生长板内凋亡细胞数量增加,证实H型内皮细胞作为部分骨骼基质消化蛋白酶的主要来源,在软骨吸收过程中发挥着重要作用。然而,在非生长板软骨内成骨过程中,H型内皮细胞是否发挥类似的基质消化功能有待进一步研究。
三、骨细胞对H型内皮细胞的调控
(一)破骨细胞对H型内皮细胞的调控
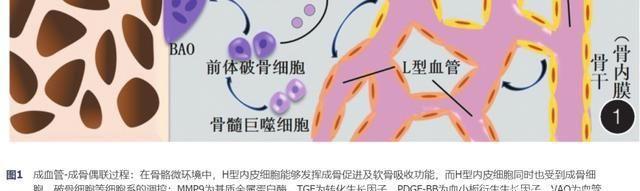
1.促进H型微血管生成:
在巨噬细胞集落刺激因子及核因子κB受体活化因子配体的作用下,单核-巨噬细胞被募集并转化为抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase, TRAP)阳性的单核细胞,即前体破骨细胞,并继续增殖融合形成多核的破骨细胞[13,14]。在骨骼内,前体破骨细胞富集于骨膜并贴近骨表面[15],与成熟破骨细胞发挥的骨吸收作用相反,前体破骨细胞具有促进血管新生及骨再生的功能[16,17],但具体机制尚不明确。Xie等[18]发现来自前体破骨细胞的条件培养基能够显著促进内皮祖细胞(endothelial progenitor cells, EPCs)的迁移,且在进一步的抗体中和实验中,仅PDGF-BB抗体消除了前体破骨细胞条件培养基对EPCs迁移的促进作用。由于成熟破骨细胞及单核-巨噬细胞均不表达PDGF-BB,Xie等[18]建立了TRAP+细胞PDGF-BB敲除的小鼠模型以模拟前体破骨细胞PDGF-BB敲除,免疫荧光结果显示干骺端及骨内膜的H型内皮细胞数量显著减少,伴随骨钙素阳性细胞数量减少,骨小梁体积及厚度明显减小,表明前体破骨细胞分泌的PDGF-BB对H型微血管新生及骨再生具有促进作用。在PDGF-BB介导EPCs表面PDGFR β磷酸化后,下游磷脂酰肌醇3-激酶/蛋白激酶B/粘着斑激酶通路被激活,从而促进H型微血管生成[18]。由于Hirschi等[19]曾在早期的研究中提出内皮细胞也能够分泌PDGF-BB。Xie等[18]建立了不同类型细胞PGDF-BB敲除的小鼠模型以寻找PDGF-BB的确切来源,并最终提出骨骼内72.6%的PDGF-BB来源于前体破骨细胞,12.6%由内皮细胞分泌,14.8%来自其他骨髓细胞。随着对前体破骨细胞研究的逐渐完善,一些PDGF-BB的上游分子被发现,如G蛋白偶联受体激酶结合蛋白1、组织蛋白酶K等分子均被证实能够调节前体破骨细胞PDGF-BB的表达水平,从而影响成血管-成骨偶联过程[18,20]。
2.协同H型微血管吸收生长板软骨:
在软骨内成骨过程中,破骨细胞曾被认为发挥基质消化的作用,有助于新生血管侵入软骨基质[21]。但随着H型内皮细胞被证实为MMP9等骨骼基质蛋白酶的主要来源,研究人员对破骨细胞在软骨吸收中发挥的具体作用产生兴趣。Romeo等[12]利用免疫组化及细胞谱系示踪,在干骺端骨-软骨交界处发现了一种新的破骨细胞亚型,此类破骨细胞定位于干骺端H型微血管拱形结构内的突起附近,且细胞数量同样与年龄增长呈负相关,因此被命名为血管相关破骨细胞(vessel-associated osteoclasts, VAOs),而在骨小梁周围发挥骨吸收作用的破骨细胞则被命名为骨相关破骨细胞(bone-associated osteoclasts, BAOs)。通过短期间断应用阿仑膦酸钠,小鼠干骺端VAOs数量减少而BAOs未受影响,导致干骺端H型微血管拱形结构被破坏,生长板及新生骨形态异常,证实VAOs能够调节H型微血管末端突起的连接,从而协同H型微血管侵入生长板软骨基质,维持骨发育过程中骨-软骨交界面的正常形态[12]。
(二)成骨细胞对H型内皮细胞的调控
神经轴突导向分子Slit同源蛋白3(slit homolog 3, Slit3)最早被认为来源于血管内皮细胞及血管平滑肌细胞,通过旁分泌及自分泌的方式作用于内皮细胞,从而促进血管新生[22]。而近期的研究发现成骨细胞Slit3表达阳性,且HIV增强子结合蛋白1作为细胞外信号调节激酶通路抑制分子,对成骨细胞Slit3的表达水平具有负向调节作用[23,24]。在Xu等[24]建立的OSX+细胞Slit3敲除的小鼠模型中,骨骼内H型内皮细胞数量明显减少,伴随骨量下降及骨皮质变薄。然而,体外应用重组Slit3蛋白刺激成骨细胞并未增强其成骨活性,这些结果证实成骨细胞分泌的Slit3通过促进H型内皮细胞生成,间接发挥促成骨作用。Slit3作用于骨髓内皮细胞表面轴突导向受体蛋白1后,激活了下游Hippo通路的重要效应分子Yes相关蛋白,从而激活骨髓内皮细胞,尤其是H型内皮细胞,在该过程中细胞外信号调节激酶/p38丝裂原活化蛋白激酶通路也被激活[24]。
但在另一项研究中,Kim等[25]提出破骨细胞分泌的Slit3通过增强成骨细胞内β-连环蛋白活性,直接促进成骨细胞的迁移和增殖,此外Slit3还具有抑制前体破骨细胞融合的功能。各项研究结果间存在一定的理论矛盾,提示骨骼内Slit3的来源及功能有待进一步验证。
四、H型内皮细胞间的信号通路
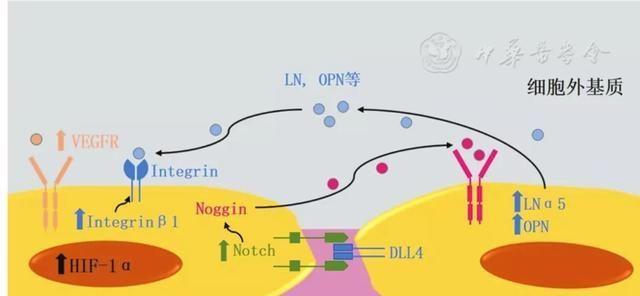
(一)Notch信号通路
一般认为,内皮细胞间δ样蛋白-4(DLL4)/Notch信号通路发挥抑制血管生成的作用[26]。但Ramasamy等[3]在研究中发现,通过敲除内皮细胞重组信号结合蛋白-Jκ(recombination signal binding protein for immunoglobulin kappa J region, RBPJκ)阻断其Notch信号通路后,小鼠骨骼内H型内皮细胞及内皮细胞总数量均减少,内皮细胞增殖能力下降,并伴随明显的骨量丢失。而敲除内皮细胞含F-框WD重复域蛋白7(f-box and wd repeat domain containing protein 7, FBXW7)后,Notch通路过度激活导致小鼠视网膜血管生成减少,但骨内H型微血管数量及内皮细胞增殖水平显著提高,该过程中内皮细胞VEGFR表达水平升高但HIF-1α水平未出现明显变化。上述实验结果证实,Notch信号通路在骨骼内发挥成血管作用,并通过增加H型内皮细胞数量促进成血管-成骨偶联过程[3]。Yang等[5]的另一项研究发现microRNA497~195簇在H型内皮细胞中的表达水平较高,其通过下调FBXW7表达激活Notch通路,显著增加了小鼠骨骼内H型微血管数量,同时加快了骨骼发育进程,这一结果再次印证了Notch通路对成血管-成骨偶联的促进作用。此外,Ramasamy等[3]发现在对内皮细胞Notch通路活性进行调控的过程中,头蛋白基因的表达水平随之显著变化,且重组头蛋白能够明显改善RBPJκ基因敲除小鼠较低的成血管及成骨水平,证实头蛋白是Notch通路介导的成血管-成骨偶联过程中的关键分子。
(二)细胞外基质分子信号
在H型与L型内皮细胞的基因富集分析中,Langen等[6]发现H型内皮细胞中与细胞外基质、基底膜形成及细胞黏附相关的分子表达水平普遍较高。通过建立内皮细胞特定基因敲除的小鼠模型,Langen等[6]分析了其中部分分子的生理功能,如整合素β1(integrin β1)、层粘连蛋白(laminin, LN)α5参与维持H型内皮细胞正常的形态及功能,骨桥蛋白(osteopontin, OPN)促进H型内皮细胞增殖,证明了H型内皮细胞在参与细胞外基质生成的同时,通过旁分泌及自分泌的方式调节血管生成。
五、总结与展望
在成血管-成骨偶联中,H型内皮细胞能够募集并刺激成骨细胞系,发挥促成骨功能;其分泌的基质蛋白酶通过促进软骨吸收,在生长板软骨内成骨过程中起重要作用(图1)。同时,H型内皮细胞的功能受微环境中成骨细胞、破骨细胞(图1)及其自身(图2)的调控。随着H型内皮细胞在骨再生中发挥的作用逐渐受到重视,除对相关基因表达的调控及内源蛋白的应用外,人工合成或提取的化合物也逐渐被用于调控成血管-成骨偶联过程,如肉叶芸香碱被Huang等[27]证明能够促进前体破骨细胞生成并上调其PDGF-BB表达水平。大量应用型研究的出现更加要求研究者对H型内皮细胞功能及调控机制的深入理解,进而推动新型骨再生策略的发展及应用。因此,本文在综述近年来研究进展的同时,也旨在发现并提出一些有待深入探究的问题,如Notch通路对骨血管生成发挥特殊促进作用的机制、Slit3确切的生理来源及对骨骼内各细胞系的作用、H型内皮细胞与VAOs在非生长板软骨内成骨中发挥的功能等。对上述问题的探索可能成为将来成血管-成骨偶联研究领域的热点。

养细胞要用好血清!

作者:王峰、徐佳、孔令驰、康庆林
来源:中华创伤骨科杂志, 2020,22(07)























