作者|陈文强(哈佛医学院张毅组博后)
来源|公众号“BioArt”
自单细胞组学技术兴起以来,越来越多的研究者使用该技术揭示不同组织的细胞类型异质性(heterogeneity),尤其对于大脑这一高度复杂的器官而言,了解其细胞类型多样性对于理解神经正常功能及揭示神经功能障碍如何参与神经精神疾病具有重要意义。近年来,通过单细胞测序(single-cell RNA-seq)技术,研究人员已经揭示了小鼠大脑具有约600类转录组不同的细胞类型【1】,而随之而来的重要科学问题是,转录组的异质性与神经元功能特征(如神经环路联系及生理功能)是否可以联系起来?
2019年10月17日,来自美国加州理工大学的David Anderson研究组 (HHMI研究员、美国科学院院士)在Cell杂志在线发表了题为 Mutilmodal analysis of cell types in a hypothalamic nodecontrolling social behavior的研究论文,通过比较两种独立的单细胞测序技术平台揭示了下丘脑腹中侧(ventromedial)腹外侧(ventrolateral) (以下简称为“VMHvl区”)的细胞类型多样性,进而比较转录组异质性和神经元解剖学特异性、投射特异性及行为激活特异性的相互关联,发现除了极少数情况下,VMHvl区的转录组细胞类型与环路联系及行为特异激活之间并无清晰对应关联。

首先,研究人员使用SMART-seq对下丘脑VMH区的细胞类型进行了研究。该技术使用Nr5a1-Cre转基因小鼠对下丘脑VMH区大部分神经元(75%)进行特异性标记,随后使用FACS进行流式分选。
该技术细胞采样率较低,每只小鼠略能采集到100个细胞,因此,研究人员最终从54只小鼠中得到4574个神经细胞,并分析得到46个转录特异的细胞类型(图1A及C)。
研究人员根据差异表达基因及对VMH区解剖结构,将这些细胞按照core/shell形态继续细分为VMH-out及VMH-in两大类,对其中VMH-in继续细分为VMHc/anterior VMH及VMHvl。该分析总共发现下丘脑VMHvl区具有17种转录特异的细胞类型。
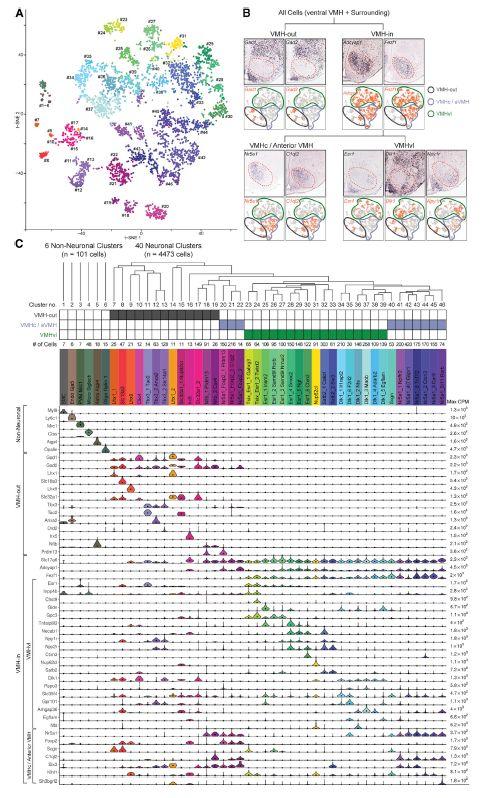
图1. SMART-seq揭示的下丘脑VMHvl区的转录特异的细胞类型
为联系SMART-seq鉴定出的17中转录特异细胞类型与解剖学定位,研究人员进行了顺序荧光原位杂交(seqFISH,图2A),并应用58个探针标记不同的SMART-seq细胞类型,通过比较seqFISH和SMART-seq的聚类分析结果,发现VMHvl的SMART-seq发现的类群和seqFISH发现的类群具有高度相关性(图2C),因此,seqFISH可以对SMART-seq分析出的类群在解剖定位上进行验证。
图2. 使用seqFISH对VMHvl区转录特异细胞类型进行解剖学分析
研究人员期待进一步回答的问题是,VMHvl转录特异的细胞类型是否可以和具有不同投射特征的神经元类群进行一一对应?研究人员借助于Esr1-Cre小鼠进行了Retro-seq【2】,在已知与VMHvl具有联系的脑区(MPOA,dPAD及lPAG)注射逆行AAV,随后进行FACS及单细胞测序(图3A-B),发现VMH转录特异的细胞类型具有明显的投射偏好,如主要位于VMHdm/c区的Nr5a1+细胞类群偏好投射与dPAG,而位于VMHvl的Esr1+及 Dlk1+细胞类群主要投射于MPOA。

图3. 单细胞测序发现的细胞类型的投射偏好
David Anderson组一直以来致力于研究VMHvl区的不同神经元集群如何参与控制交配行为(mating)及攻击行为(aggression)。该课题组曾使用神经元活动性记录的多种技术,如多通道电生理记录、c-fos catFISH原位杂交技术及在体钙成像记录技术,均揭示了该区域的神经元具有既有重叠又显著不同的神经元类群。因此,下一个研究问题是,VMHvl区的转录特异的细胞类型多样性与VMHvl神经元活动性之间是否具有关联?
众所周知,通过SMART-seq技术结合即早基因(IEG)表达分析极其困难。研究人员在数次尝试失败后,转而使用10X genomics来进行IEG分析,并避免了使用FACS进行细胞分选,最终从90只小鼠的下丘脑VMH得到了约15万个单细胞进行分析。
对于这15万个单细胞,研究人员分析出了29个转录特异的细胞类型,其中17个可根据其标志物归为VMHvl特异细胞类型(图4E),这些神经元同样也可以分为三大类,分别可被Esr1、Satb2、Dlk1进行标记。研究人员随后使用了八种不同行为范式研究基于10X技术的转录特异细胞类型和行为激活之间的关联。
研究人员首先使用Fos作为神经元激活标记物,随后使用了139个不同即早基因作为神经元激活标记物,最后使用非活动依赖的差异表达基因进行区分,以研究转录特异细胞类型和行为激活之间的关联。
研究人员发现,对于大部分社交行为,1-3个转录特异细胞类型可被激活,而这些单个细胞类型也可被多个行为激活,也有少部分类群仅被特定行为范式激活,如Nup62cl类群只可被社交恐惧行为激活,而Dlk1_1类群只可被交配行为激活。
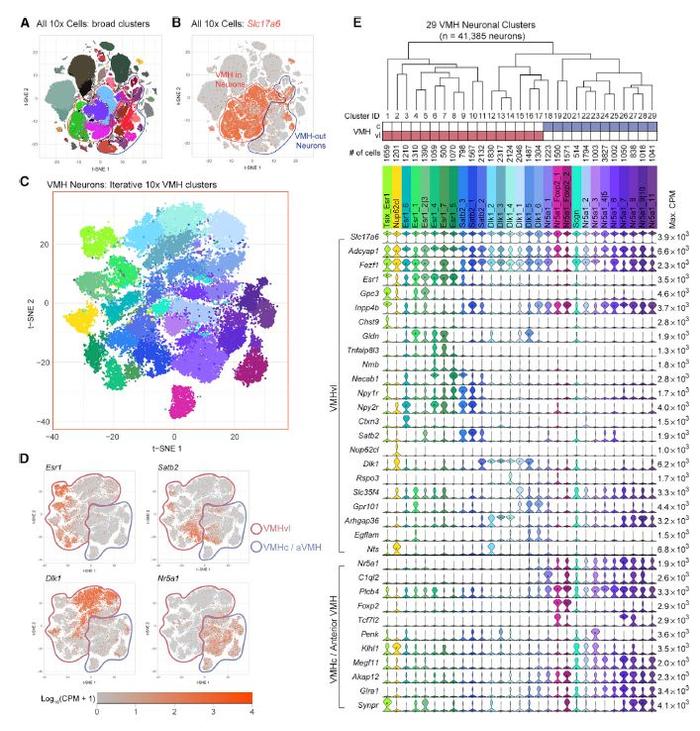
图4. 使用基于10Xgenomics平台的单细胞测序技术揭示下丘脑VMHvl区转录特异的细胞类型
研究人员最后使用CCA分析,对SMART-seq和10X数据库进行了匹配,以验证在转录特异细胞类型、行为学激活和投射特异性这三者是否具有关联。研究人员观察到了SMART-seq和10X单细胞测序上具有非常好的匹配度(详见原文图6A)。
但是令人惊讶的是,研究人员并未在转录特异细胞类型、行为学激活及投射偏好上发现清晰的一对一关联。唯一例外的是,上述提到的可被社交恐惧激活的Nup62cl细胞类群,具有显著的投射至lPAG偏好(图5A,见黄色区域)。
基于该课题组一直以来侧重研究的VMHvlEsr1神经元,研究人员使用传统的病毒示踪及Fos荧光染色方法,对Esr+神经元在攻击行为、交配行为及male-female探究行为的激活状态进行了研究,发现被攻击行为激活的VMHvlEsr1神经元偏好投射至dPAG而非MPOA(图5D),这提示研究人员应该在CCA分析中找到某个既被攻击行为偏好激活、又只投射至dPAG,然而,研究人员未能鉴定出该类同时具有转录特异、行为激活范式特异、且投射偏好特异的神经元类群。
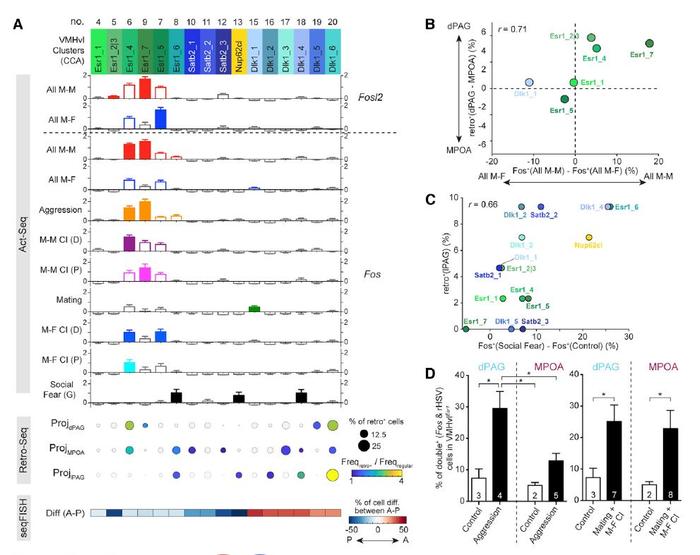
图5. 使用CCA分析揭示行为激活、投射偏好及转录特征之间的关联
总而言之,本文使用SMART-seq和基于10X genomics的单细胞测序技术,均揭示了VMHvl区具有17种转录特异的细胞类型,并用smFISH确定了单细胞测序的结果,同时也确认了这些细胞类型具有大脑前后侧的解剖学分布限制,也发现了几个非常罕见的同时具有行为激活特异、环路联系特异的VMHvl细胞类型。
本文在讨论部分也提及了近期哈佛大学庄小威课题组和CatherineDulac课题组合作发表的下丘脑视前区单细胞测序结合MERFISH的工作【3】。该工作与本文得到了不同的结论,即该Science文章认为“下丘脑视前区存在遗传上编码的环路,能组成转录特征的神经元细胞类型以控制特定下丘脑功能”。
这篇Cell文章中,研究人员认为得出显然不同结论的原因可能在于揭示VMHvl区转录特异细胞类型的方法略微不同。另外一个可能原因是,视前区的神经元类型大多为GABA能,因此可能与VMHvl这一以谷氨酸能神经元占主导地位的下丘脑核团有所不同。
笔者所在的哈佛医学院张毅教授课题组在2017年也通过单细胞测序技术揭示了下丘脑细胞类型多样性【4】,与另一个同期发表的工作【5,6】相似的是,这些研究均使用了单细胞测序技术在整个下丘脑或下丘脑亚核团鉴定出了30-60个转录特异的细胞类型。然而,纯粹使用单细胞测序技术对某个全脑或某个脑区进行细胞类型多样性鉴定工作,已经非常难以在顶级期刊上发表。
这篇David Anderson课题组发表的Cell文章集中在某个亚核团,并比较了两种不同的单细胞测序技术,分别鉴定出了近似数量和分类的细胞类型。而更为重要的意义在于,本文应是首次将转录组水平的细胞类型多样性和神经功能特征联系起来,不仅探讨了解剖学上的局限定位,也尝试联系了投射特异性及行为激活的相关性。
笔者认为,尽管本文并未得到具有脑区特异性的新的逻辑规则,但也给后续其他核团的单细胞测序的功能验证工作提供了一种可借鉴思路,即如何在单细胞转录组中挖掘出具有重大意义(如行为相关性、投射偏好特异性等功能相关验证)的信息,仍然是我们每个单细胞组学研究者应该重点思考的问题。
最后想简单提到的是,笔者关注David Anderson课题组多年,曾多次在组会Journal Club上介绍该课题组的工作。Anderson组一直以来非常集中于研究下丘脑VMHvl核团表达雌激素受体1(Esr1)的神经元。
笔者介绍过该组在2011年发表在Nature上一个非常杰出的工作【7】(第一作者Lin Dayu博士现为纽约大学副教授,领导独立课题组)。该工作使用catFISH和在体多通道记录技术,揭示VMHvl区具有重叠却显著不同的两类神经元分别编码交配行为与攻击行为,也被药理学及光遗传学手段得到充分必要性验证。
随后,该课题组一直以来以该工作为基础,使用最前沿的技术挖掘出新信息,如2014年该课题组在Nature发表的论文使用了光遗传结合脑片双光子钙成像【8】,2017年该课题组在Nature发表的论文使用了在体钙成像技术同样观测下丘脑VMHvl Esr1+的神经元的活动性【9】。这些工作既系统连贯,又能结合最前沿的技术挖掘出新信息,因此,该课题组在本篇Cell中使用单细胞测序技术对VMHvl核团的细胞类型特异性进行深度挖局,也是这一系列原创性工作之后自然而然、水到渠成的。读者应从该该课题组一系列连贯、前沿的的原创工作中得到些许启发。
原文链接:
https://doi.org/10.1016/j.cell.2019.09.020
题图:
vox.com
参考文献:
1. Saunders A, Macosko EZ, Wysoker A, et al.(2018) Molecular Diversity and Specializations among the Cells of the AdultMouse Brain. Cell.174(4):1015-1030ell.
2. Tasic B, Yao Z, Gravbuck LT, et al.(2018) Shared and distinct transcriptomic cell types across neocortical areas. Nature. 563(7729):72-78
3. Moffitt JR, Bambah-Mukku D, Eichhorn SW,et al. (2018) Molecular, spatial, and functional single-cell profiling of thehypothalamic preoptic region.Science.362(6416).
4. Chen R, Wu X, Jiang L, Zhang Y. (2017) Single-cellRNA-seq reveals hypothalamic cell diversity. Cell Reports. 18(23): 3227-3241.
5. Romanov RA, Zeisel A, Bakker J et al.,(2017) Molecular interrogation of hypothalamic organization reveals distinctdopamine neuronal subtypes. Nature Neuroscience. 20(2):176-188
6. Campbell JN, Macosko EZ, Fenselau H, etal. (2017) A molecular census of arcuate hypothalamus and median eminence celltypes. NatureNeuroscience. 20(3):484-496
7. Lin D, Boyle MP, Dollar P, et al. (2011)Functional identification of an aggression locus in the mouse hypothalamus. Nature. 470(7333):221-6.
8. Lee H, Kim DW, Remedios R, et al. (2014)Scalable control of mounting and attack by Esr1+ neurons in the ventromedialhypothalamus. Nature.509(7502):627-32.
9. Remedios R, Kennedy A, Zelikowsky M, etal. (2017) Social behaviour shapes hypothalamic neural ensemble representationsof conspecific sex. Nature.550(7676):388-392.







