【脑科学科普】专栏
第012期

#脑海Yeah第21期#
文 | 罗蕊
炎炎夏日没食欲,冬天不自觉囤肉御寒,说的是不是你?不过放心,这可不是个例,摄食行为普遍具有环境温度依赖性。Mandic et al.采集了18名加拿大士兵在高、中、低三种温度下士兵食欲,发现高温下士兵食欲明显低于低温下[1]。Stelmach-Mardas et al.发现人体能量摄入具有明显季节性,冬季摄入量明显增高[2]。
实际上,关于摄食行为的调节众说纷纭。Brobeck等人认为大鼠摄食行为并不是机体整体能量代谢速率与核心体温所决定,而是作为机体体温调控的一种方式。食物的消化吸收会引起体温升高,并且升高程度因食物成分而异,摄入更多的食物是为了产生更多的能量,以抵御低温环境,而摄食量降低,是为了降低产热,以降低高温环境下散热负荷[3]。Mayer等的“糖平衡理论”认为下丘脑腹内侧核与外周血管内存在血糖感受器,通过感受血糖浓度变化,调节每餐摄食量,是摄食行为的一种短期调节因子[4]。Kennedy等的“脂肪平衡理论”认为体内脂肪现有储备会通过生化作用调节机体的长期食物摄入量,以保证机体脂肪储备平衡,当摄食行为可能影响机体脂肪储备时,摄食行为会被抑制[5]。
那温度低食欲是好了,那“为了御寒”真的可以成为心安理得大吃特吃的借口吗?在另一篇研究[5]中发现在丛林等热带环境与极地等冷环境下能量消耗程度近似,但是在热环境下能量摄入要明显低于冷环境下。这提示,在不同温度环境下,能量摄入的不同有可能并不一定源于能量消耗的差异,有可能是由于环境温度直接影响了食欲。也就是说,大冬天食物摄入增多,但能量消耗没有同幅度增多的话,肉肉还是得长在你身上的。
接下来,我们对摄食行为与环境温度的相关性,以及背后的调节机制进行进一步了解。
01
摄食行为是否具有温度依赖性?
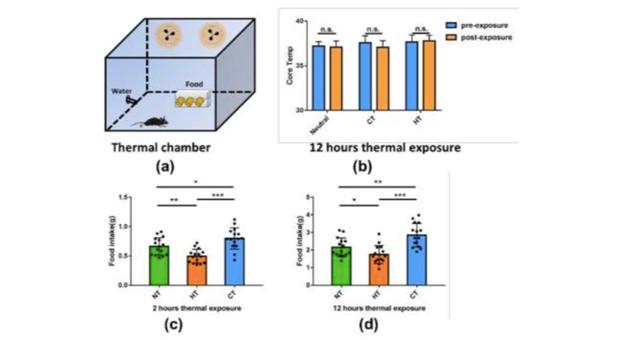
图1.恒温控制舱及环境温度暴露下小鼠摄食量。(a)恒温舱室示意图;(b)小鼠在三种温度条件下暴露12h核心温度;(c)三种温度条件暴露2h小鼠摄食量;(d)三种温度条件暴露12h小鼠摄食量。
探究不同温度下小鼠摄食量及核心体温变化,在高温(33.52)、室温(252) 、低温(102)对小鼠禁食12h后,记录2小时及12小时内摄食量及体温变化,分别表征短时温度暴露及长时温度暴露下小鼠摄食行为的变化(图1)。
结果显示在两种暴露时长下,高温下小鼠摄食量显著低于常温和低温,而低温下小鼠摄食量明显高于高温与常温条件下。同时该强度的高低温条件未造成小鼠核心体温明显变化。本实验表明在不引起核心体温改变的情况下,外周温度刺激即可引起摄食行为的明显变化。
02
这种相关性主要是通过神经调节还是体液调节来实现?
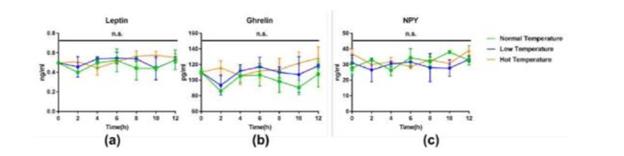
图2. ELISA测定三种温度暴露12h中小鼠血清食欲相关激素变化曲线。(a)三种温度下血清素leptin变化曲线;(b)三种温度下血清胃饥饿素ghrelin变化曲线;(c)三种温度下血清Y神经肽NPY变化曲线。
对不同温度环境下,小鼠体内主要影响摄食行为的几种激素水平进行测定。通过对三种温度条件下小鼠血清中Leptin、Ghrelin、NPY的浓度测定,我们发现小鼠三种激素水平在不同温度条件下并无显著差异(图2)。上述结论表明在12h长时间的环境温度暴露中,小鼠三种激素水平变化并没有表现出明显的温度依赖性。
03
哪个脑区与摄食(或说饥饿状态)相关?
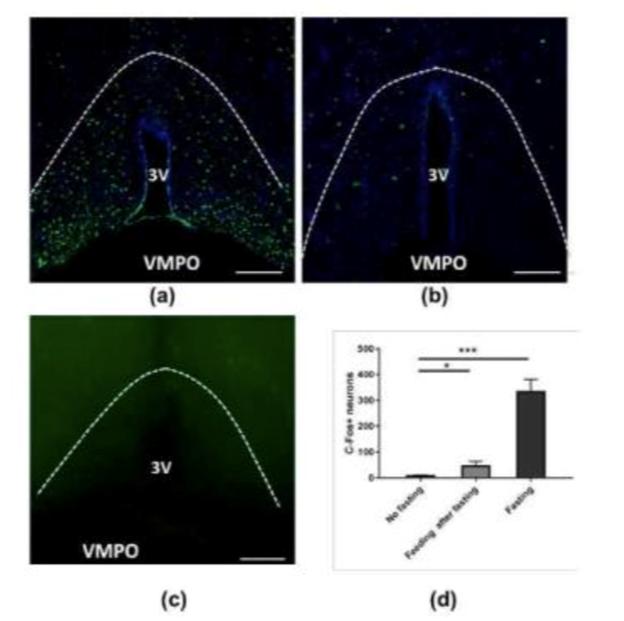
图3. 野生型小鼠VMPO部位在饥饿与饱食状态下C-FOS表达情况。(a)小鼠禁食24h后VMPO部位C-FOS表达情况;(b)小鼠禁食24h后给予2h摄食后VMPO部位C-FOS表达情况;(c)对照组,不做任何禁食处理的小鼠C-FOS表达情况;(d)三组小鼠VMPO部位C-FOS阳性神经元数目统计。
将一组野生型小鼠不给予温度刺激的情况下,禁食24小时后发现VMPO(ventromedial preoptic area,下丘脑中腹内侧视前区)有大量c-fos(神经元活动性标志物)表达,而对照组禁食24小时后给予2小时摄食,发现VMPO c-fos消失(图3)。这一结果表明VMPO存在一群神经元在无温度相关刺激中也会对机体饥饿状态做出响应,而饱食后活动消失。
04
VMPO部位与禁食和饥饿状态相关的是哪一类神经元?
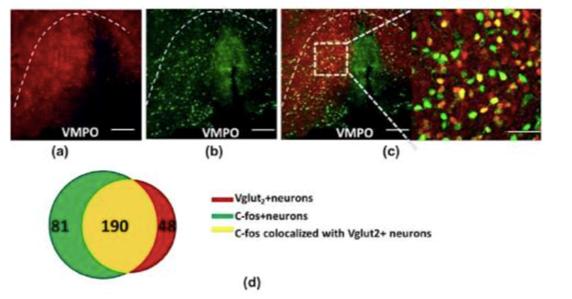
图4. Ai9::Vglut2-ires-cre小鼠禁食后VMPO部位C-FOS与谷氨酸能神经元共标情况。(a)VMPO部位谷氨酸能神经元分布;(b)禁食12h后VMPO部位C-FOS表达;(c)谷氨酸能神经元与C-FOS共标情况;(d)谷氨酸能神经元与C-FOS共标数目统计。低倍图像标尺100um,高倍图像标尺50um。
可见禁食后激活的c-fos阳性神经元与Vglut2阳性神经元有大量共标(图4)。
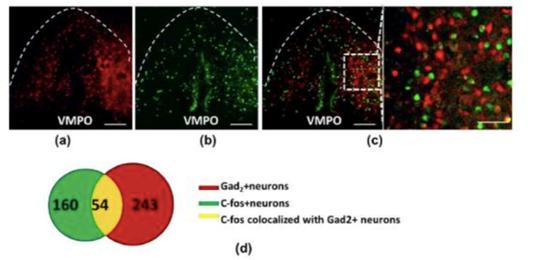
图5. Ai9::Gad2-ires-cre小鼠禁食后VMPO部位C-FOS与谷氨酸能神经元共标情况。(a)VMPO部位GABA能神经元分布;(b)禁食12h后VMPO部位C-FOS表达;(c)GABA能神经元与C-FOS共标情况;(d)GABA能神经元与C-FOS共标数目统计。低倍图像标尺100um,高倍图像标尺50um。
而c-fos与Gad2阳性神经元共标情况一般(图5)。通过这种形态学的研究初步表明了VMPO神经元与小鼠摄食状态(或说饥饿状态)有关的神经元绝大多数时兴奋性的谷氨酸能神经元,而抑制性神经元只是占少数。
05
VMPO部位在摄食行为中具体发挥着怎样的作用?这些作用又涉及到何种神经元?
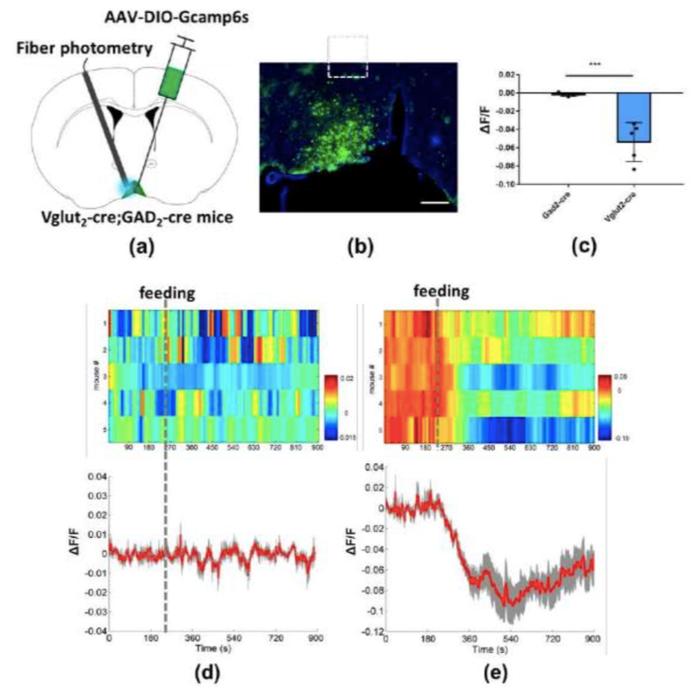
图6. Gad2-cre与Vglut2-cre小鼠在禁食24h后摄食过程中VMPO部位的钙信号变化。(a)病毒注射与光纤记录方案;(b)VMPO部位Gcamp6s表达脑片图像;(c) Gad2-cre与Vglut2-cre两种小鼠在开始摄食5min内钙信号变化平均值对比统计图;(d) Gad2-cre小鼠在禁食24h后15min摄食钙信号变化;(e) Vglut2-cre小鼠在禁食24h后15min摄食中钙信号变化。标尺100um
将小鼠禁食24h后记录小鼠在摄食过程中的钙信号来反映神经元活动性变化情况。Gad2-cre小鼠VMPO部位神经元活动性无显著变化,而Vglut2-cre小鼠在开始摄食5min后活动性大幅下降。在开始摄食5min内,Vglut2-cre小鼠VMPO神经元活动性要显著低于Gad2-cre小鼠(图6)。上述结果表明,小鼠在禁食24h后,处于高度饥饿状态,开始摄食后随着饥饿程度的缓解,VMPO部位GABA能神经元并无显著的活动变化,而高度激活的谷氨酸能神经元随着饥饿程度的缓解,活动性开始下降,并恢复正常。
06
VMPO部位神经元兴奋状态与体温调节的关系如何?
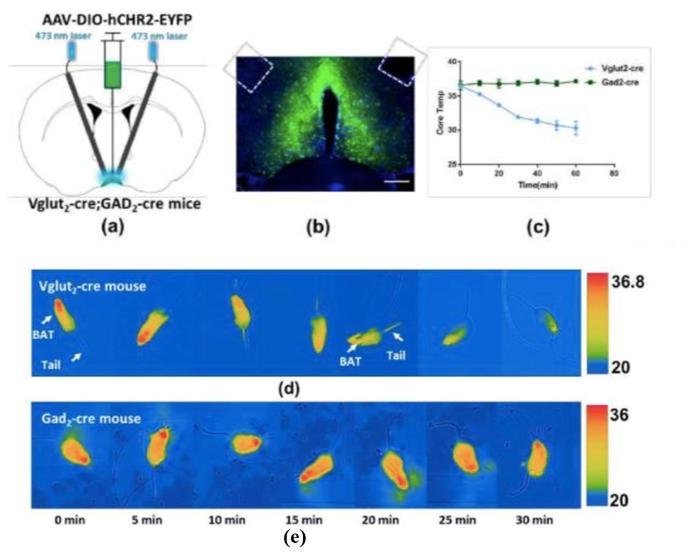
图7. 光激活Vglut-cre与Gad2-cre小鼠VMPO部位体温及摄食变化情况。(a)两种小鼠光遗传病毒注射与陶瓷埋置方案;(b)VMPO部位表达光遗传病毒CHR2脑片示意图;(c)两种小鼠光激活60min内核心体温变化曲线;(d)Vglut-cre小鼠光激活30min体表温度红外成像;(e)Gad2-cre小鼠光激活30min体表温度红外成像。
VMPO部位的谷氨酸能神经元兴奋后,会抑制机体产热,增加散热,体温快速下降。而VMPO部位GABA能神经元的激活,并未能引起小鼠外周温度与核心体温的变化(图7)。
07
VMPO部位神经元兴奋性与摄食行为的关系如何?
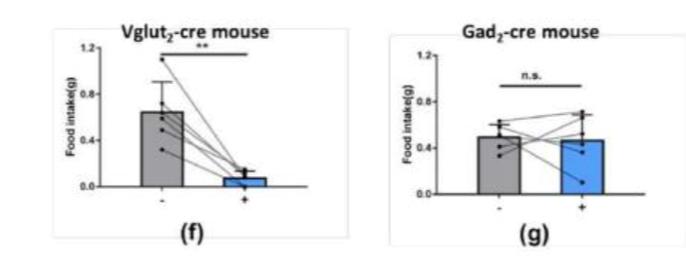
图8. (f)Vglut2-cre小鼠光激活2h内摄食量与无光刺激情况下对比;(g)Gad2-cre小鼠光激活2h内摄食量与无光刺激情况下对比。
谷氨酸能神经元兴奋后摄食量大幅度降低,而GABA能神经元兴奋与否不会对摄食量造成影响(图8)。
以上两趴实验表明,VMPO部位谷氨酸能神经元激活后,小鼠表现出摄食行为的抑制,也表现出核心体温的大幅调整,造成体温失衡,无疑会严重影响摄食行为。因此,在这里我们尚不能确定是由于谷氨酸能神经元的兴奋直接抑制了摄食活动,还是由于体温失衡引起的间接效应,需要后续再进一步的剖析,探究VMPO能够特异性调控摄食行为的神经投射环路。VMPO区域抑制性GABA能神经元对小鼠摄食行为无调控作用,因此可暂时不考虑GABA神经元对VMPO参与温度依赖性摄食行为的调控机制。
综上所述,温度相关的摄食行为调节主要涉及到下丘脑中腹内侧视前区(VMPO)部位的谷氨酸能神经元,该类神经元的兴奋不仅可以升高体温,也会降低食欲、抑制摄食行为。也就是说,冬天食欲大增可并不一定是源于“我需要能量!”的号令,也可能单纯是天冷就想吃,所以在大快朵颐的同时也需稍加注意哦。不过在7月份说这个还为时尚早,在夏日里不妨喝点酸梅汤开开胃。
参考文献:
[1]. Interactions between the default network and dorsal attention network vary across default subsystems, time, and cognitive states[J] . Matthew L. Dixon,Jessica R. Andrews-Hanna,R. Nathan Spreng,Zachary C. Irving,Caitlin Mills,Manesh Girn,Kalina Christoff. NeuroImage. 2017
[2]. Neuronal circuits that regulate feeding behavior and metabolism[J] . Jong-Woo Sohn,Joel K. Elmquist,Kevin W. Williams. Trends in Neurosciences. 2013 (9)
[3]. Resting-state BOLD oscillation frequency predicts vigilance task performance at both normal and high environmental temperatures[J] . Xiaopeng Song,Shaowen Qian,Kai Liu,Shuqin Zhou,Huaiqiu Zhu,Qihong Zou,Yijun Liu,Gang Sun,Jia-Hong Gao. Brain Structure and Function. 2017 (9)
[4]. Galanin-Expressing GABA Neurons in the Lateral Hypothalamus Modulate Food Reward and Noncompulsive Locomotion[J] . Emily Qualls-Creekmore,Sangho Yu,Marie Francois,John Hoang,Clara Huesing,Annadora Bruce-Keller,David Burk,Hans-Rudolf Berthoud,Christopher D. Morrison,Heike Munzberg. Journal of Neuroscience. 2017 (25)
[5]. Gs[alpha] deficiency in the dorsomedial hypothalamus underlies obesity associated with Gs[alpha] mutations[J] . Min Chen,Yogendra B Shrestha,Brandon Podyma,Zhenzhong Cui,Benedetta Naglieri,Hui Sun,Thuy Ho,Eric A Wilson,Yong-Qi Li,Oksana Gavrilova,Lee S Weinstein. Journal of Clinical Investigation. 2017 (2)
[6]. 钱绍文. 极端温度环境下摄食行为及注意功能异常的神经机制研究[D].中国人民解放军陆军军医大学,2020. (原文)
脑科学转化研究院
官网:itbr.fudan.edu.cn
邮箱:itbr@fudan.edu.cn
前期阅读: