瞬时受体电位香草酸1型受体(TRPV1)是多模态激活的、钙通透的非选择性阳离子通道,广泛表达于参与痛觉感知的神经元中,在疼痛的感知中发挥重要作用。TRPV1孔区外侧(OPD)是温度、质子和其他毒素多肽调控通道活性的关键区域,因而靶向此区域理性设计TRPV1的调控分子是调控疼痛反应的潜在策略。
2023年1月3日,来自浙江大学基础医学院生物物理学系的杨帆团队、浙江大学脑科学和脑医学院学院的徐贞仲团队和青岛大学药学院的齐昀坤团队在Nature Communications杂志发表研究长文Structure-guided peptide engineering of a positive allosteric modulator targeting the outer pore of TRPV1 for long-lasting analgesia,靶向TRPV1通道的孔区外侧,理性设计了多肽类正向变构调节剂s-RhTx,揭示了s-RhTx和TRPV1结合的分子机制,并阐明了s-RhTx在小鼠多种疼痛模型中表现出长效镇痛效果的机制。

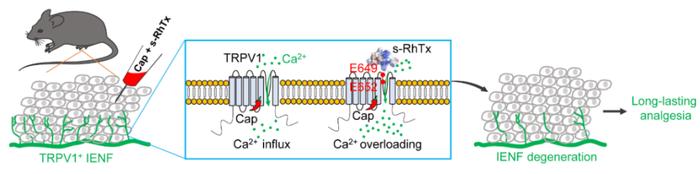
为发展靶向TRPV1 孔区外侧(OPD)的调控分子,该团队对结合于TRPV1 OPD的红头蜈蚣毒素(RhTx)进行理性改造,得到截短的多肽s-RhTx。与RhTx直接激活TRPV1不同的是,s-RhTx无法直接激活TRPV1,但它以浓度依赖性的方式增强辣椒素和质子诱发的TRPV1 电流,而不改变TRPV1的热激活阈值,说明s-RhTx 是TRPV1的正向变构调节剂(PAM)。在分子层面,研究人员通过分子对接,首先计算预测了s-RhTx和TRPV1的相互作用,并基于对接结果在OPD引入一系列点突变,结合电生理膜片钳和钙成像评价了点突变对s-RhTx的反应,揭示了位于pore loop的E649和E652对于s-RhTx发挥作用十分关键。随后,研究人员通过基于电生理的热力学双突变循环实验,进一步证明了E652位点和多肽R12/K22之间存在特定的相互作用。
在钙离子存在时,TRPV1被辣椒素激活时会发生迅速脱敏,而s-RhTx显著减缓辣椒素诱导的TRPV1脱敏过程,从而导致表达TRPV1的细胞发生钙超载而死亡,提示在体内实验中联用低剂量辣椒素和s-RhTx可诱导表达TRPV1的表皮内神经纤维(IENF)退化而发挥镇痛效果。为了验证这个猜想,研究人员在小鼠自发痛和CFA诱导的慢性炎症痛模型中评价了s-RhTx的镇痛效果。结果显示联用s-RhTx和低剂量辣椒素在不引发DRG神经元胞体死亡的情况下,通过诱导IENF的可逆性退化而发挥长效镇痛效果,单次注射后,在CFA诱导的慢性炎症痛模型中可以发挥超过3周的镇痛效果。值得注意的是,s-RhTx对小鼠体温无明显影响,这克服了以往TRPV1拮抗剂改变动物体温的副作用。
本研究进一步证实了发展TRPV1通道的正向变构调节剂是非常有潜力的镇痛策略,不仅报道了具有成为镇痛剂潜力的多肽s-RhTx,同时也提出了TRPV1通道的两个变构位点,为后续开发靶向TRPV1的调控分子开发打下了基础。
浙江大学基础医学院生物物理学系博士研究生张恒和浙江大学脑科学和脑医学院学院的博士研究生林佳佳为该工作的共同第一作者。浙江大学基础医学院生物物理学系的杨帆研究员、浙江大学脑科学和脑医学院学院的徐贞仲研究员和青岛大学药学院的齐昀坤副教授为本文的共同通讯作者。
杨帆课题组专注于离子通道膜蛋白的功能与动态构象变化研究,以及基于蛋白质三维结构的生物大分子理性设计。围绕着刺激感受的TRP通道,深入研究了低温、高温、辣椒素、薄荷醇以及多肽大分子等多种物理化学因素调控TRP通道的机制,并开发了针对TRP通道的具有镇痛效果的调控分子。杨帆课题组目前在蛋白三维结构解析方向招聘博士后,也招聘电生理、蛋白质计算建模与理性设计等研究方向的博士后加盟,杨帆课题组详细信息请见实验室网站:
https://person.zju.edu.cn/fanyang
原文链接:
https://www.nature.com/articles/s41467-022-34817-1


















