脊椎动物中枢神经系统的突触传递主要依赖于兴奋性离子型谷氨酸受体(iGluRs) 和抑制性GABAA受体。在典型的兴奋性突触传导中,突触间隙释放的谷氨酸结合突触后iGluRs,驱动阳离子通道打开,后膜去极化。GluD1和GluD2受体与其他iGluR的区别在于:它们对谷氨酸不敏感,且在与配体结合时无法对离子孔道进行门控,它俩被认为通过结合 D-丝氨酸(或甘氨酸)或通过代谢型信号转导。
这种机制已经在 GluD2 受体中得到了很好的表征:突触后 GluD2 结合cerebellin-1,跨越突触间隙,参与突触形成、维持和可塑性,但GluD1的功能如何,还不清楚。
之前的研究发现GluD1 受体在整个前脑中表达,参与兴奋性突触发生,调节 AMPA 和 NMDA 受体之间的平衡。此外,在抑制性突触后也发现存在GluD1 受体(iGluR), 被认为参与新皮层中抑制性突触的形成。2023年12月,法国巴黎文理研究大学Pierre Paoletti和Laetitia Mony,以及英国MRC分子生物学实验室A. Radu Aricescu,在Science上发表研究工作。结合生化、结构和功能分析,将 GluD1 鉴定为控制抑制性突触可塑性的 GABA 能受体,挑战了谷氨酸能和 GABA 能受体之间的经典二分法。

1. GABA能够结合GluD1受体
研究者首先在 GluD1 中引入A654T (Ala654→Thr) 突变,保持组成型活性,同时插入突变 C645I (Cys645→Ile) 以匹配等效的GluD2 M3 孔段。研究者将这种双突变体称为GluD1-Lurcher,可以发现这些电流能被 D-丝氨酸和甘氨酸增强(图 1A-C),但对谷氨酸几乎不敏感(图 1C)。
随后研究者测试了 GluD1 受体感知GABA的能力。结果发现GABA在低毫摩尔范围内具有明显的亲和力,比D-丝氨酸低,但与甘氨酸相似,并且具有相同的功效(图1B-C)。相比之下,GABA对GluD2-Lurcher受体基本上无效。
接下来,研究者使用了电压钳荧光法 (VCF),一种检测配体(或电压)诱导的膜蛋白构象变化技术,揭示了GABA在非Lurcher GluD1受体上结合并引发构象变化的能力(图1D-F)。将D-丝氨酸、甘氨酸或GABA添加到结合缺陷的GluD1受体上时,未检测到荧光信号(图1E和F),这表明配体在GluD1 LBD的结合是关键的初始分子事件。基于VCF的剂量反应曲线显示激动剂在亚毫摩尔范围内具有明显的亲和力。对分离的LBD进行的热位移测定和等温滴定量热法(ITC)实验也证实, GABA似乎是GluD1受体的活性配体,而不是GluD2受体。
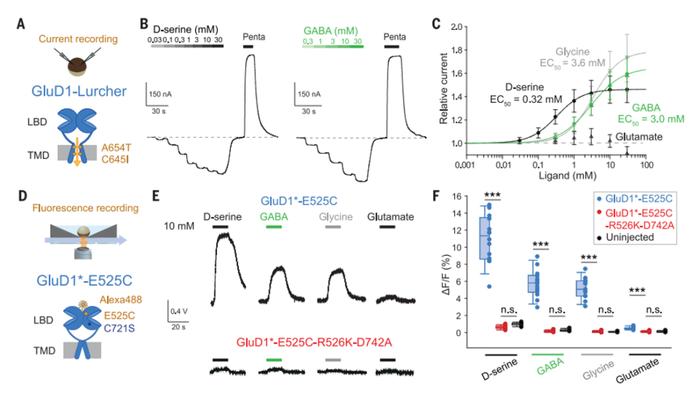 图1:GABA 结合并触发 GluD1 受体的构象变化
图1:GABA 结合并触发 GluD1 受体的构象变化2. GABA 结合区域的结构
为了解GluD1如何与GABA相互作用,研究者使用X射线确定了GluD1 LBD-GABA复合物的晶体结构(图2C-D)。GABA 结合中央 LBD 叶间裂隙,并且与上叶和下叶形成多种相互作用(图 2D-E)。此外,GABA结合口袋中排列着三个芳香族酪氨酸(Y)残基,包括GluD1-Y492,它充当GABA分子顶部的盖子(图2D-E)。总体而言,配体结合姿态与 D-丝氨酸结合到 GluD2 受体 LBD 所描述的姿势非常相似 。
 图 2.GABA-GluD1 和 D-丝氨酸-GluD1 LBD 复合物的结构
图 2.GABA-GluD1 和 D-丝氨酸-GluD1 LBD 复合物的结构3. GABA选择性的分子机制
为了检查 GluD1 GABA 结合和选择性分子基础,研究者进行了基于结构的诱变实验。结果发现:将LBD上叶残基E446替换为Ser(S)、Gln(Q)或Asp(N)消除了GABA对GluD1-Lurcher电流的影响,但D-丝氨酸仍然活跃(图3A-C)。更保守的E446D(Glu446→Asp)突变体虽然亲和力降低,但对两种配体没有区分性和保留敏感性(图3C)。这些与 E446 与 GABA 但不与 D-丝氨酸发生离子相互作用的结果保持一致,因此确定 E446 是 GABA 识别的关键。在 GluN1 中引入第二个突变 [突变体 GluN1-Q405EQ536Y (Gln536→Tyr)] 后更好地模拟 了GluD1 GABA 结合环境,进一步增强了 GABA 对 NMDA 受体的门控功效(图D-E)。在GluN1-Q405E-Q536Y/GluN2A受体上,GABA作为辅助激动剂的功效达到甘氨酸的50%(图3F),这些结果确定了E446和Y539是GluD1受体中GABA识别的关键决定因素。
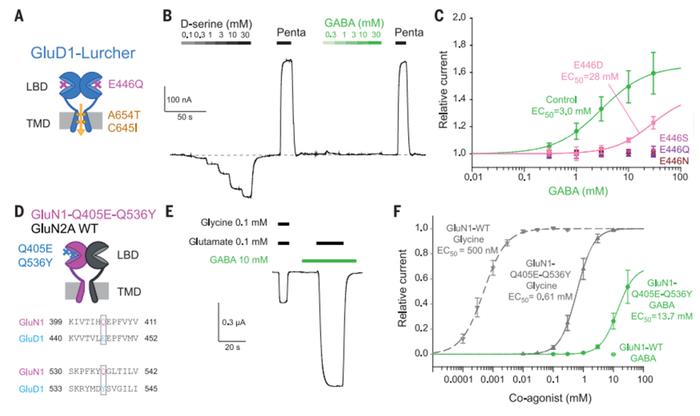 图 3.GluD1受体识别GABA的分子决定因素
图 3.GluD1受体识别GABA的分子决定因素4. GABA binding to GluD1
controls inhibitory synaptic strength
最后研究者评估了 GluD1 激活对成熟 GABA 能突触突触传递的影响。研究者重点关注小鼠海马体的分子层 (SLM),该区域富含 GluD1 受体(图 4A)。共聚焦显微镜成像显示,GluD1 优先积聚在抑制性突触而不是兴奋性突触(图 4B)。GluD1 介导抑制性神经传递的增强需要配体与细胞外支架蛋白 cerebellin 结合和相互作用,而不是通过 GluD1(图 4D-I )。抑制性可塑性在缺乏D-丝氨酸信号转导的小鼠中是保守的(图4J)。因此,SLM CA1海马GABA能突触中GluD1受体的激活通过依赖于跨突触锚定的非离子性GABA诱导机制诱导抑制性突触强度的增强。
总结
综上研究表明,在小鼠海马体的 SLM 中,GluD1作为结合 GABA 并控制抑制性突触可塑性的受体,在 GABA 能突触中起作用。
人类的GluD1 突变与自闭症、精神分裂症、以及重度抑郁症的易感性有关。GluD1受体具有驻留在兴奋性和抑制性突触的双重能力,不仅专门作为突触回路的强大调节剂,而且是神经精神疾病兴奋抑制失衡的脆弱节点。因此本项研究发现的 GluD1 受体是具有混合特征的分子机器——结构上是谷氨酸能但功能是 GABA 能,为 GluD1 靶向神经药理学开辟了新的视角。
但作者也在讨论中提到,将GluD1 激活与 GABAAR 活性调节相结合的详细机制仍有待破译,这种以前未知的GABA能突触可塑性形式是否与其他形式的抑制性可塑性相互作用仍未解决,这为后面的工作提供了方向。
原文链接:
https://doi.org/10.1126/science.adf3406
参考文献
Piot, Laura et al. “GluD1 binds GABA and controls inhibitory plasticity.” Science (New York, N.Y.) vol. 382,6677 (2023): 1389-1394. doi:10.1126/science.adf3406
编译作者:Zoey(brainnews创作团队)
校审:Simon(brainnews编辑部)

















