高考新宠——速率常数及其应用
【知识点归纳】
1、速率常数
(1)含义:速率常数(k)是指在给定温度下,反应物浓度皆为1 mol·L-1时的反应速率。在相同的浓度条件下,可用速率常数大小来比较化学反应的反应速率
(2)速率常数的影响因素:与浓度无关,但受温度、催化剂、固体表面性质等因素的影响,但温度对化学反应速率的影响是显著的,速率常数是温度的函数,同一反应,温度不同,速率常数将有不同的值。通常反应速率常数越大,反应进行得越快。不同反应有不同的速率常数
2、速率方程:
(1)定义:一定温度下,化学反应速率与反应物浓度以其计量数为指数的幂的乘积成正比

【真题感悟】
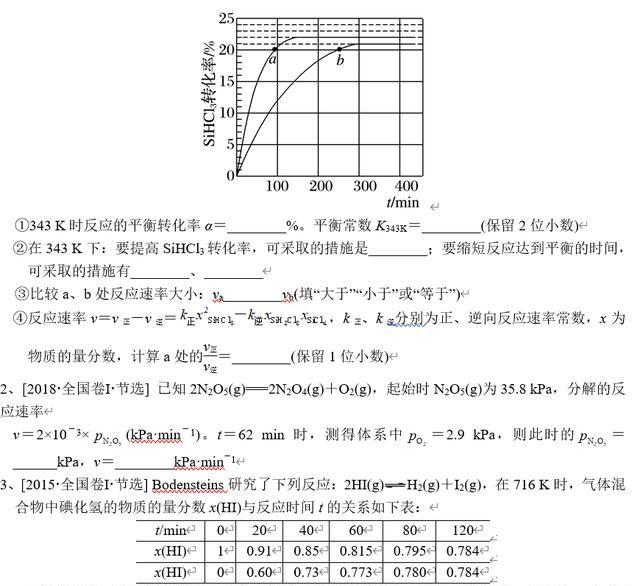
1、[2018·全国卷Ⅲ·节选]三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。对于反应:2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
4、[2016·海南卷·节选]顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化,该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K1=________

则n=__________,k正=__________mol-3·L3·s-1。达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(填“增大”“减小”或“不变”)
4、T1温度时在容积为2 L的恒容密闭容器中发生反应:2NO(g)+O2(g)2NO2(g)ΔH
v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:

(1)从0~2 s内该反应的平均速率v(NO)=________mol·L-1·s-1。
(2)T1温度时化学平衡常数K=________。(结果保留3位有效数字)。
(3)化学平衡常数K与速率常数k正、k逆的数学关系是K=__________。若将容器的温度改变为T2时其k正=k逆,则T2________(填“>”“T1

②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是_________(填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和


① 353.15 K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)
②323.15 K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________
③ 比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正=,v逆=,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,


【速率常数及其应用】答案
【真题感悟】
1、①220.02②及时移去产物改进催化剂提高反应物浓度③大于④1.3
解析温度越高,反应速率越快,达到平衡的时间越短,左边曲线达到平衡的时间短,则此曲线代表343 K时SiHCl3的转化率变化,右边曲线代表323 K时SiHCl3的转化率变化。



7、①
解析:①达到平衡后,在其他条件不变时,升高温度,化学反应速率加快,由于v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),V增大,说明k正、k逆增大,由于升高温度,化学平衡向吸热的逆反应方向移动,说明逆反应速率增大的倍数大于正反应速率增大的倍数,所以k正的倍数
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下发生该反应,达到平衡时,CO的转化率为40%,



由图可知:温度升高,该平衡转化率增大,升温平衡正向移动,则正向是吸热反应。
②323.15 K时,要缩短反应达到平衡的时间即加快反应速率,可采取的措施有改进催化剂、增大压强或提高反应物浓度;
(4)a、b两处转化率相同,说明消耗的SiHCl3等量的,但a的时间比b的短,a的反应速率快,故va>vb;

说明平衡逆向移动,根据温度对化学平衡移动的影响,升高温度,化学平衡向吸热的逆反应方向移动,所以T2>T1;④A.由于第一步反应为快反应,第二步反应为慢反应,所以反应速率:υ(第一步的正反应)>υ(第二步的反应),A错误;B.当化学反应分多步进行时,总反应快慢由反应慢的化学反应决定,对该反应来说由第二步反应决定,B正确;C.反应快的说明反应的活化能低,需要较少的能量反应就可以发生;反应慢的说明反应的活化能高,发生反应需要较高的能量,所以第二步的活化能比第一步的高,C正确;D.即便是反应慢的化学反应,反应物分子之间的碰撞也不都是有效碰撞,所以第二步中N2O2与O2的碰撞不可能100%有效,D错误;故合理选项是BC。
15、CD
【解析】













